CONCRETO & Construções | 83
degenerativa do magnésio no concreto
é a sua substituição do cálcio no prin-
cipal produto de hidratação da pasta
de cimento, o silicato cálcico hidra-
tado, representado por C-S-H. A for-
mação de M-S-H, fase extremamente
porosa, causa perda das proprieda-
des ligantes (BATTAGIN,1990). Para-
lelamente, o magnésio substitui o cál-
cio da portlandita Ca(OH)
2
, formando
Mg (OH)
2
(brucita). Por essa razão, um
dos elementos de diagnose de ataque
do magnésio na pasta de cimento é
a presença de silicatos hidratados de
magnésio e brucita. A norma de me-
todologia prescrita pela ABNT NBR
12655: 2015 para determinação de
íons magnésio é a UNE 83955:2008.
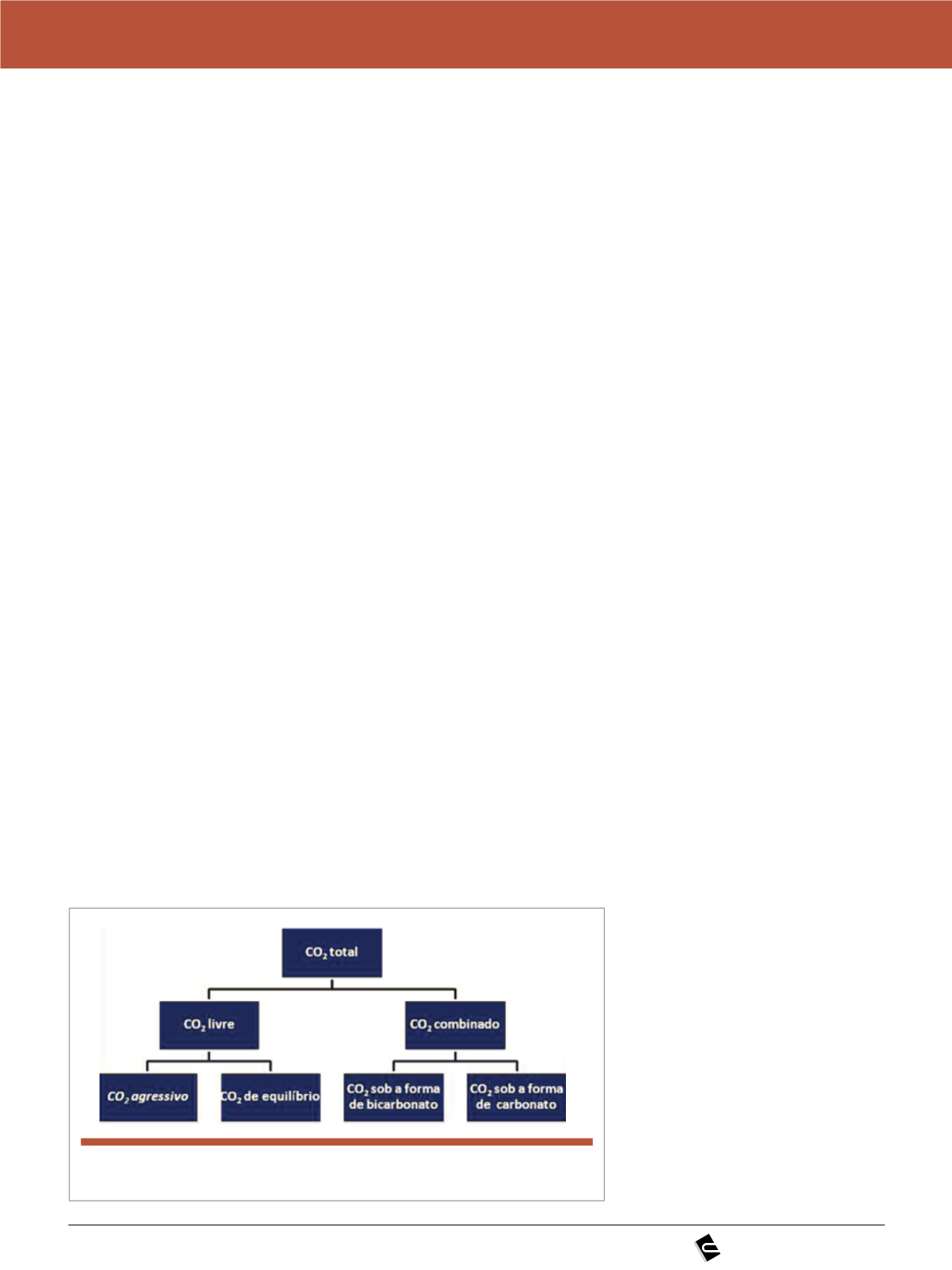
2.4 Por que limitar o
CO
2
agressivo?
O dióxido de carbono (CO
2
) agressi-
vo corresponde ao dióxido de carbono
dissolvido na água que, sob a forma de
ácido carbônico (H
2
CO
3
), apresenta po-
tencial para atacar o concreto. O ácido
carbônico reage com a pasta de cimen-
to ou até com os agregados,quando
estes forem de origem calcária. É ne-
cessário enfatizar que o CO
2
total cor-
responde a somatória do CO
2
combi-
nado como carbonatos e bicarbonatos
mais o CO
2
livre (ver Figura 3).
Existem, por sua vez, duas formas
de CO
2
livre:
u
CO
2
livre de equilíbrio da reação
H
2
O + CO
2
+ CaCO
3
⇄
Ca (HCO
3
)
2,
que corresponde ao necessário
para manter os bicarbonatos em
solução;
u
CO
2
livre agressivo.
O dióxido de carbono agressivo re-
presenta o dióxido de carbono livre em
excesso em relação ao dióxido de car-
bono em equilíbrio, disponível para for-
mar ácido carbônico, sendo responsá-
vel pela dissolução do carbonato, daí o
nome de dióxido de carbono agressivo.
Ao contrário, se o teor de dióxido
de carbono livre for inferior ao teor de
dióxido de carbono de equilíbrio, há
precipitação de carbonato. Neste caso,
a água é incrustante, ao contrário do
caso anterior, em que é dissolvente
(CINCOTTO, 1995). Daí a importância
de adotar uma metodologia adequa-
da para a determinação do dióxido de
carbono agressivo. Não existe norma
brasileira de determinação do dióxido
de carbono agressivo, sendo que o
meio técnico recorre à norma espanho-
la UNE 13577:2007, que é a prescrita
pela ABNT NBR 12655: 2015.
Por fim, é necessário esclarecer
que o dióxido de carbono agressivo
está geralmente presente apenas em
águas naturais puras. Como as águas
geralmente contêm sais dissolvidos, a
presença de carbonato de cálcio é su-
ficiente para combinar com o dióxido
de carbono, formando bicarbonato de
cálcio, que, ao contrário do CO
2
agres-
sivo, não é danoso ao concreto.
2.5 Por que limitar o Amônio?
Os íons NH
4
+
são considerados ra-
ros em águas subterrâneas, a menos
que se tratem de interação destas com
solos contaminados por resíduos in-
dustriais ou em caso mais específico
de atividades ligadas ao uso de fertili-
zantes em agricultura (BRE, 2015).Por
esse motivo análises rotineiras para de-
finir o grau de agressividade de águas e
solos são raramente realizadas quanto
aos íons NH
4
+
, embora a normalização
nacional e internacional preveja essa
possibilidade.Os sais de amônio atuam
como agentes de troca catiônica com o
cálcio, transformando os produtos cál-
cicos insolúveis da hidratação da pas-
ta endurecida de cimento em sais de
cálcio solúveis que são lixiviados pela
água (CETESB,1988). Simultaneamen-
te há desprendimento de gás amônia
que resulta num aumento da porosida-
de do concreto, deixando-o vulnerável
a outros ataques. Os sais de amônio
comportam-se como ácidos fracos e
colaboram para atacar a pasta endure-
cida, removendo o hidróxido de cálcio,
embora numa taxa lenta. Não se deve
negligenciar a presença de sulfato de
amônio ((NH4)
2
SO
4
) em ambientes su-
jeitos a derramamento de fertilizantes,
pois é considerado um dos agentes
mais agressivos ao concreto, sendo
que esse ataque pode ser duplo pelos
u
Figura 3
Esquema dos tipos de CO em água em contato com estruturas de concreto
2


